纯度很重要:为什么不同的细胞外囊泡EV分离纯化方法会产生不同的结果

简介:您是否想知道:是否改变纯化方法会影响检测到的EV分离物的生物活性,或者甚至是他们的装载货物或标记?阅读下面的内容,你就会知道这就是为什么。
方法很重要。更改工艺流程中的一件事可能完全改变您的结果。 这对于细胞外囊泡(EV) 分离和其他技术来说都是如此,但这对您的研究意味着什么?
为了讨论这个问题,我们将Kronstadt 等人(2022) [1]发表的文献作为一个案例研究。通过他们的案例,深入探讨了他们的结果的细节,并讨论您的EV 分离纯化中可能存在污染的原因和存在方式。
友情小提示:与其他技术相比,使用qEV Gen 2 尺寸排阻柱可以显著减少污染!
您如何确定 EV分离物的生物活性是否取决于EV本身?
为了解答这个问题,Kronstadt等人(2022) 使用了可靠的HEK293T 细胞。然后分别使用超速离心(UC)、切向流过滤(TFF) 、qEVoriginal 35 nm Series Gen 2尺寸排阻将EV分离纯化出来。首先他们发现,无论采用哪种技术,EV粒径大小在统计上都没有变化(图1)。

图1. 通过超速离心(UC)、切向流过滤(TFF) 和 qEV Gen 2尺寸排阻柱从培养瓶中培养的HEK293T 细胞中分离出的细胞外囊泡的大小。虚线代表mode粒径,而周围的实心区域代表误差。改编自 (Kronstadt et al. 2022) [1]。
这个研究接下来调查了抑制小鼠巨噬细胞中脂多糖(LPS) 诱导的炎症的能力。在这里,需要特别注意的是HEK293T细胞不会释放抗炎EV。
为了进一步测试是否可以检测到错误的生物活性,作者研究了三种细胞因子/趋化因子的分泌,并进行了各种实验以了解任何抑制特性的来源。他们运用ELISA检测细胞因子/趋化因子的分泌。
活性EV成分或FBS污染物?
当应用于巨噬细胞时,使用三种技术分别获得的EV分离物都导致了LPS引发IL-6 分泌的抑制现象。因此,似乎结论是IL-6 分泌的抑制因子可能是基于EV的。 但是,由于新鲜培养基与HEK293T 条件培养基同样能够抑制IL-6,所以此抑制因子也可能来自培养基而非HEK293T细胞(图2)。具体来说,它可能来自胎牛血清(FBS) (图2B)。
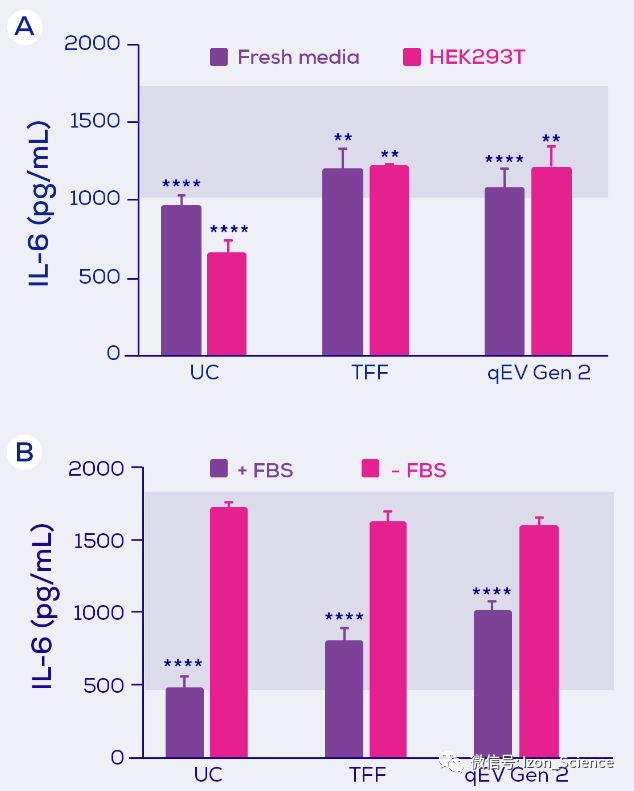
图2. LPS诱导的小鼠巨噬细胞的IL-6分泌。小鼠巨噬细胞暴露于LPS ,和分别使用超速离心(UC)、切向流过滤(TFF)或 qEV Gen 2 尺寸排阻柱进行EV分离的新鲜培养基(± 胎牛血清;FBS)或HEK293T 条件培养基(+ FBS)。蓝色阴影区域代表暴露于LPS 的最大分泌量和暴露于LPS 加上一种抑制剂的最小分泌量。统计结果由Tukey post hoc test的双向方差检测。** = p<0.01;**** = p<0.0001。改编自Kronstadt 等人(2022)[1].
在研究 LPS 引起的RANTES 分泌(一种趋化因子)时,只有UC 分离纯化(以及在另外一些实验中,TFF)导致分泌的抑制。由于与qEV分离纯化相比,UC与更大程度的可溶蛋白质污染相关。因此这种情况下,对RANTES的抑制因子可能是可溶性蛋白质。与IL-6抑制一样,实验表明对RANTES的抑制因子似乎来自培养基中的FBS,而不是细胞本身(图3)。
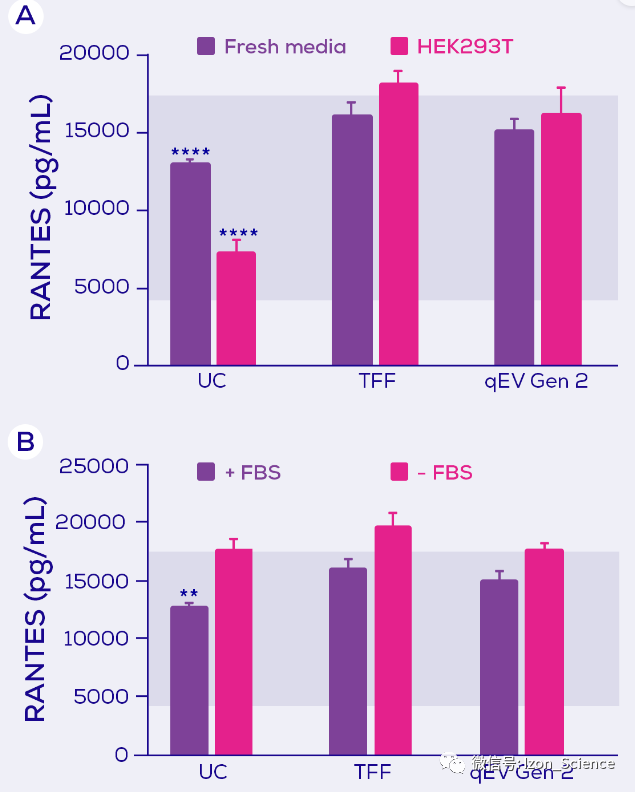
图3. 暴露于 LPS 的小鼠巨噬细胞RANTES的分泌。小鼠巨噬细胞暴露于LPS ,和分别使用超速离心(UC)、切向流过滤(TFF)或 qEV Gen 2 尺寸排阻柱进行EV分离的新鲜培养基(± 胎牛血清;FBS)或HEK293T 条件培养基(+ FBS)。蓝色阴影区域代表暴露于LPS 的最大分泌量和暴露于LPS 加上一种抑制剂的最小分泌量。 统计结果由Tukey post hoc test的双向方差检测。** = p<0.01; **** = p<0.0001。 改编自Kronstadt 等人(2022)[1].
最后,对于TNF-α,只有TFF(在另外一些实验中,UC)分离出TNF-α分泌的抑制因子。该抑制因子似乎存在于新鲜培养基中,并且在更大程度上存在于HEK293T 条件培养基中(图4)。
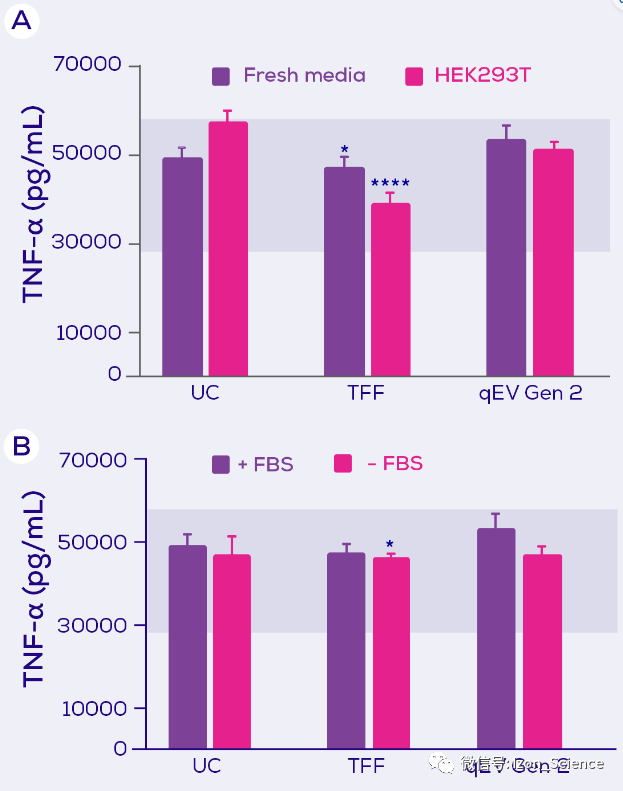
图4. 暴露于 LPS 的小鼠巨噬细胞的TNF-α分泌。小鼠巨噬细胞暴露于LPS ,和分别使用超速离心(UC)、切向流过滤(TFF)或 qEV Gen 2 尺寸排阻柱进行EV分离的新鲜培养基(± 胎牛血清;FBS)或HEK293T 条件培养基(+ FBS)。 蓝色阴影区域代表暴露于LPS 的最大分泌量和暴露于LPS 加一种抑制剂的最小分泌量。 统计结果由Tukey post hoc test的双向方差检测。 * = p<0.05;**** = p<0.0001。 改编自Kronstadt 等人(2022) [1].
总结
总体而言,很明显,使用SEC (文中qEV Gen 2 柱)分离EV可提供纯净的EV分离物,与UC或TFF相比,它大大降低了非EV来源的污染。分离方法越纯粹,分离中出现非EV的可能性就越低。
然而,作者还强调了使用FBS 时的一个重要考虑因素。FBS 应添加到培养基中,然后使用UC法去除EV。无论分离方法有多好,它都无法区分您希望样本中出现的EV和样本中不希望出现的其他来源的EV。
这对您的EV分离意味着什么?
您可能刚刚更改了EV分离纯化流程(或者您可能正在考虑这样做)并且看到了与以前不同的结果。虽然这非常令人沮丧,但了解此更改的原因很重要。运用qEV Gen 2系列,我们能比以往提高EV分离纯化的纯度。正如您在图 5中所见,Gen 2系列具有明显更高的EV与蛋白质比率,该比率通常用于EV 领域作为纯度的衡量标准。凭借可提供如此的高纯度和快速且可反复的分离纯化方法,相信您已经有很多理由选择qEV Gen2尺寸排阻柱进行EV分离纯化。
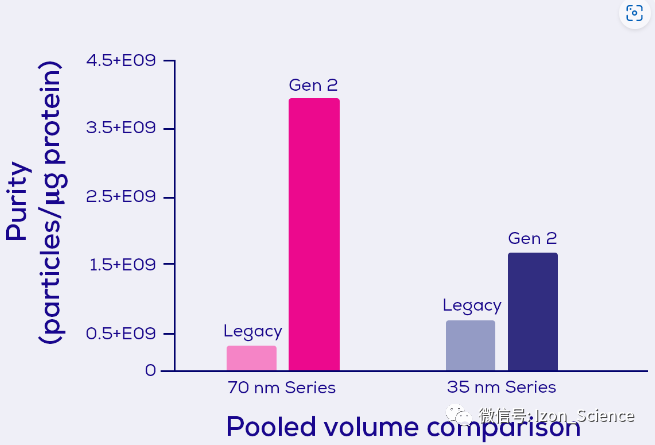
图 5. 每微克蛋白质的细胞外囊泡(EV) 数量,分别通过可调谐电阻脉冲传感技术和二辛可宁酸测定法测量。 显示了使用Izon 的自动馏分收集器(AFC) 和 70 nm 和 35 nm 系列的 qEVoriginal Gen 2 尺寸排阻柱(0.5 mL 上样体积)分离的人血浆样品的数据(来源于Izon内部数据)。
与第一代Legacy尺寸排阻柱或其他方法相比,我们的Gen 2提纯技术可能会改变您对EV的认识。更棒的是,这也可能会改变一些实验假设!当然,改变你的假设是乏味的,但最终它是一件好事。这意味着你现在比以前更正确。我们对科学中“真实”的看法总是随着方法的改进而改变。站在精度革命的最前沿,并通过今天的qEV Gen 2 尺寸排阻柱改进EV的分离纯化。Izon Gen 2尺寸排阻柱现已上市,适用于150 μL 至 100 mL的样品量,您甚至可以以折扣价批量购买!
如果您需讨论 qEV Gen 2 尺寸排阻柱系列如何帮助您在EV分离纯化中获得更高的纯度,或查询批量折扣,请联系我们。
参考文献
Kronstadt, S. M., Van Heyningen, L. H., Aranda, A. & Jay, S. M. Assessment of anti-inflammatory bioactivity of extracellular vesicles is susceptible to error via media component contamination. Cytotherapy (2023). https://doi.org:10.1016/j.jcyt.2022.12.002
转载来源:Izon Science







 Drug Screening/Molecular Biology
Drug Screening/Molecular Biology

