研究故事分享:从细胞外囊泡miRNA捕获诊断信号

简介:我们采访了阿姆斯特丹UMC首席研究员、Exbiome联合创始人Michiel Pegtel,就细胞外囊泡分离、诊断应用和EV-miRNA生物标志物开发进行讨论。
细胞外囊泡微小RNA(EV-miRNA)是EV运载货物中的一种,可为疾病提供信息。EV-miRNA作为一种长度约为22个核苷酸的短单链RNA分子,其生物学意义和临床潜力备受关注。Michiel Petel是阿姆斯特丹UMC的首席研究员,也是EV诊断公司Exbiome的联合创始人。在有机会与Michiel Pegtel交谈后,我们介绍了他的研究旅程,并分享了他对可重复性、分离性和EV诊断的未来的看法。
早期研究:EV介导的转移
Pegtel很早就开始了EV方面的研究;虽然目前他专注于转化研究,但他对这一领域的迷恋始于对基础生物学问题的探索。“这一切都始于我在美国读博士的时候,” Pegtel回忆道。“我论文导师的一个合作者来自荷兰。他研究了EB病毒(Epstein-Barrvirus),他说他在一些癌症组织切片中看到了这种肿瘤病毒的一种蛋白质,在一些确定没有被这种病毒感染的细胞周围也有存在。”
这位荷兰合作者,Jaap Middeldorp教授,怀疑这种病毒蛋白是由受感染的细胞分泌的。加上Pegtel对EBV miRNA的兴趣,他们开展了成功的合作。他们一起迅速获得了一项研究病毒miRNA功能转移的经费,并很快在PNAS上发表了一篇题为“通过外泌体的病毒miRNA功能递送”的论文 [1]。Pegtel说:“我们提供了EVs的miRNA功能转移的第一个证据。”虽然EBV只感染B细胞和上皮细胞,但Pegtel等人(2010)在非B细胞(T细胞)中检测到大量的EBV-miRNA,并有进一步的间接证据表明EV介导的转移。例如,他们表明EBV-miRNA由B细胞释放并存在于EVs中,并且当EVs被单核细胞来源的树突状细胞内化时,他们证明了剂量依赖性的miRNA介导的对已确认的EBV靶基因的抑制。
“我们不仅在体外试验证明了这一点,我们还证明了活体试验中发生了转移。我认为很多人都忽略了这一点。我们非常幸运地获得了这项研究中来自艾滋病患者的样本,该研究现在已经被引用了1000次,所以这是一个良好的开始。”Pegtel说。“但这也很困难,因为一开始,人们并不真的相信EV介导的细胞间通讯是一种真正的生物现象。”
外泌体来自多泡体的直接证据
外泌体以其缓慢崛起而闻名,科学界花了很长时间才认识到其独特的生物生成模式和废物处理之外的作用。部分原因是由于很难证明囊泡是由细胞内部结构产生的。
为了探索外泌体释放事件,Pegtel和他的同事完成了一项成像实验,现在他认为这是他最自豪的成就之一[2]。“我们重新设计了一种神经生理学领域产生的工具。它被称为pHluorin,是一种对pH敏感的绿色荧光蛋白。我们将pHluorin标记在CD63的外部环上,并提供了我认为的唯一直接证据,证明多泡体与质膜融合,释放外泌体” Pegtel说。CD63-pHluorin在多泡体(MVB)的酸性腔内保持淬灭状态,但在MVB与质膜融合后,荧光迅速增加,可通过活体显微镜检测到。所有先前的证据都是静态图像不能区分与膜融合的小囊泡或释放囊泡的膜出芽事件。此外,因为这些都是高度动态的过程,所以很难捕捉到这些事件。”
从早期开始,Michiel Pegtel就一直致力于几个长期目标,包括开发一种基于EV的诊断测试,同时——重要的是——产生可重复的数据,这些数据将对其他人有用。
EV-miRNA必须从非囊泡来源的miRNA中筛选出来
目前,围绕EV-miRNA的生物学特性以及如何以有意义和可重复的方式利用EV-miRNA数据存在许多悬而未决的问题。对Pegtel来说,他的主要研究问题来自于在其他信号背景下,从活细胞中分离EV-miRNA的挑战。
Pegtel说:“首先,外泌体携带RNA,其中一些RNA确实在内腔中,并受到保护免遭外部RNA酶降解。” “或者,它可以在膜上,或在外面,通过与蛋白质结合或在一个复合物中以某种方式受到保护。很多人已经证明了使用酶-例如,如果你使用蛋白酶K -那么突然间RNA就可以被RNA酶接近并被降解。实际上只有很小一部分在内腔中或以某种方式埋在这些囊泡的膜中。”
EVs中的miRNA比例可能很小,但这并不意味着它们的生物标志物不如非EV的循环miRNA有吸引力。在某种程度上,与其他细胞外来源的miRNA相比,EV对miRNA中的保护作用具有优势。“我敢说,这更稳定。使用总miRNA从血清中获得的信号更多的是由于各种你无法控制的过程,并且不太可能对任何疾病状态提供信息。”Pegtel解释道。这在诊断中尤其重要,因为一个不稳定的生物标志物永远不会是一个好的生物标志物。如果你的生物标志物有可能在你测量它之前就被降解,那么你就有可能在不可靠的数据基础上犯临床错误。
“但如果你真的对信号通信方面感兴趣,或者至少对识别活细胞释放的东西感兴趣,例如,快速分裂的肿瘤细胞,你仍然需要将这些信号与非囊泡来源的信号分离。”
在噪音背景下,能够从快速分裂的肿瘤细胞中过滤和解读EV-miRNA数据,将改变诊断学的游戏规则。这正是正在研Pegtel研究的,以霍奇金淋巴瘤为模型。
EV-miRNA测序:但首先需要将EV分离
人们普遍认为,可重复性的研究和诊断试验需要可重复性EV分离的基础,而可重复性显然是Pegtel热衷的领域。“我认为,对于一个年轻的科学领域来说,有时候说'看,我们能做到'过于乐观,然后就永远无法复制了。通常,重现数据的成本很高,所以很多人甚至都不这么做。如果没有人能复制它……它毫无用处,那你怎么能自豪呢?事实上,它只会让人们花费大量资金去试图重现它,这是一个重大打击。”
但这不仅仅是关于资金和保持研究在正确的轨道上。在诊断领域,再现性的重要性怎么强调都不为过。“如果我真的想研发一个测试,测试结果能被接受吗? 例如,因为这个测试而不让病人接受某种治疗?” 我能对病人这么说吗? 我的测试够好吗? 你知道,这是一个不同于研究的问题,在研究中,准确性的标准要低得多,尽管它可能不应该这样。”
“如果分离纯化不标准化,它有偏差,或者它一次有效,另一次显然不有效,这对诊断来说是不好的。你需要从同一个血浆样本中得到一致的结果。”
Pegtel回顾了EV研究的早期,当时超速离心法(UC)是标准方法: “我们很早就注意到,UC很容易出错。然后一些人开始使用蔗糖梯度,但这不是你可以应用于1mL的样本,甚至更少的用于诊断的方法。你需要使用比这更适用和可扩展的方法。”
多年来,Pegtel和他的团队一直在使用尺寸排阻色谱柱,最近,qEV色谱柱已可以帮助实现规模化。“现在,我们用自动化的SEC以更系统的方式纯化外泌体,这似乎对我们的目的非常有效。”

从概念验证和PCR向测序和诊断开发的转变
“霍奇金淋巴瘤有一种相对同质的免疫细胞群,它们不应该存在,比如T细胞浸润、单核细胞和中性粒细胞。简单的想法是,如果这些免疫细胞正在迅速分裂,它们将吐出(更多)外泌体,就像它们在细胞培养中那样,也许我们可以在血浆中看到相似的现象——只要我们取等量的血浆来通过尺寸排阻色谱柱。然后寻找我们在体外试验中发现的miRNAs。”
最初,Pegtel的团队使用qRT-PCR研究EV-miRNA。尽管定量检测方法繁琐,但他们在开发可区分PET阳性霍奇金淋巴瘤患者与PET阴性患者的定量检测方法方面取得了重大进展。Pegtel指出,如果他们每件事都做得仔细而正确,他们可以在治疗前发现血浆中特异性EV-miRNA水平的升高,并在治疗成功后发现这些水平的下降。“你可以看到,这些水平多年保持在低水平,随着复发又上升。所以,我认为这是第一次证明miRNA诊断的可行性,并告诉你一些关于肿瘤活动的信息。它与PET成像非常吻合,” Pegtel说。
“唯一的问题是,你如何在诊所里做到这一点?怎么把它变成真正的检测呢?所以我们一直在忙这个。”
Pegtel现在的重点是将EV-RNA测序数据解释为可用于临床的标准。这涉及从1mL血浆中检测代表400个miRNA及其变体的约10,000个分子。要充分理解如此庞大的数据库是一个非常大的挑战,需要一个系统的计算方法。为此,Pegtel从人类基因组计划中获得灵感,并致力于开发人类参考外泌体miRNA谱。
“如果你发现了差异,那么这与疾病有关吗?” Pegtel问道。“你可以将所有的miRNA相互标准化,比如可以说10%的miRNA来自于miRNA-21。如果在一个病人身上,一个像let7这样的microRNA比例显著增加,那么这意味着其他miRNA比例下降。这种方法就变得非常敏感。”
Pegtel继续说,“绝对定量很难做到,但如果你有准确的相对定量,那么你就可以更容易地将一个患者与其他患者进行比较,并开始思考,这些miRNA从哪里来?它们的生物学意义是什么?这些变化有多稳定?”
可运用临床的EV-miRNA精确诊断仍需要时间
Pegtel指出,需要时间来整理足够的数据,以建立人类的参考EV-miRNA谱,并承认该团队在他们的研究中发现了一些干扰因素。然而,鉴于目前为止从大量数据点上看到的有前景的结果,Pegtel乐观地认为,通过机器学习,这将是可能的。重要的是,Pegtel意识到精准和质量控制的必要性,这将是确保该项目成为临床相关工具的关键。
“如果我们可以掌控所有步骤——测序、血液处理,确保没有批量效应——做到这一点,我们就可以诊断这种疾病,并识别不同类型的应答者:非常好的应答者、部分应答者、无应答者,以及真正处于临床缓解期、不再病情活跃的患者。根据EV-miRNA的谱图,我们将可以看到其中的差异。这很令人兴奋。”
参考文献

Gen 2 qEV纯化柱带给您更纯净的外泌体,如下图Gen 2 qEV10参数, 10mL人血浆上样:
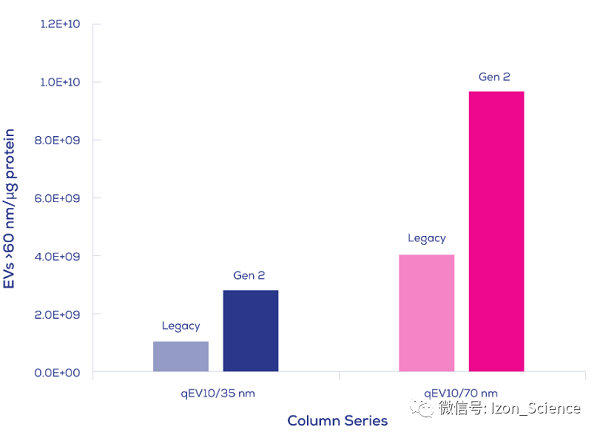
转载来源:Izon Science
欢迎关注伯齐官方微信(微信公众号:Bio-Gene)
回复:视频,查看更多相关视频
长按/扫描以下二维码可识别关注公众号

伯齐科技有限公司
Bio-Gene Technology Ltd.
广州伯齐生物科技有限公司
热线:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 广州 成都 济南








 药物筛选/分子生物学
药物筛选/分子生物学