脑脊液细胞外囊泡(CSF EV)的研究现状
简介:脑脊液(CSF) EV作为中枢神经系统疾病的诊断和监测的生物标志物,具有巨大的潜力。然而,该领域目前缺乏研究之间的可重复性,使得一致性几乎不可能实现。本文探讨了CSF EV的分离纯化,总结迄今为止的关键发现,并提出该领域发展的相关问题。
虽然脑脊液(CSF)不像血浆那样容易获得,但它在寻找神经退行性疾病和中枢神经系统(CNS)癌症的生物标志物,以及监测某些治疗方法(例如对艾滋病毒患者)与中枢神经系统相关的副作用方面的可能是无价的。细胞外囊泡(EV)是纳米大小、脂包被的囊泡,包含蛋白质、RNA和来自原细胞的小分子。由于这些珍贵的货物,研究脑脊液中的EV在寻找疾病中的脑源性生物标志物方面具有重大的意义。在这篇文章中,我们讨论了CSF的组成及其对其EV分离方法的意义。此外,我们将深入研究CSF EV,并讨论该领域的改进机会。
CSF的组成
脑脊液包裹着大脑和脊髓,提供机械保护,同时促进细胞间通信和维持中枢神经系统稳态。脑脊液的组成与血浆有很大的不同(表1),脑脊液的可溶性蛋白水平非常低 [1,2]。CSF中EV的浓度也明显较低 [3],这可能是一个意想不到的优势。脑脊液与身体其他部位的相对分离,减少了这种生物液体中EV的来源,使脑源性EV占主导地位。虽然由于缺乏良好的标记物,关于脑脊液中脑源性EV的比例的知识有限,但一项研究发现,脑脊液中16.1%的脑特异性蛋白是神经元蛋白,83.9%是胶质蛋白 [4]。
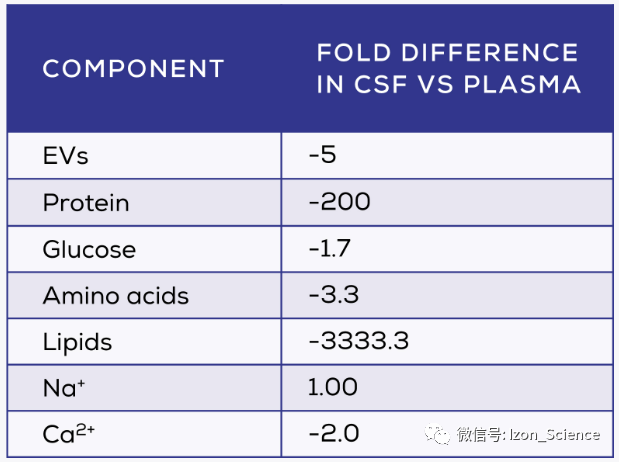
表1. 脑脊液和血浆成分对比 [1-3]。
从CSF中分离EV的特别注意事项
从脑脊液中分离EV所面临的挑战不同于其他生物液体。例如,超速离心(UC)可从血浆中分离出大量的颗粒——尽管不是非常纯净的EV,且可能EV的生物功能遭到损伤——但超速离心法未能从脑脊液中分离出许多EV [3,5]。相比之下,基于尺寸排除色谱(SEC)的qEV分离柱(qEV 35 nm系列)已被证明可以有效地从CSF [5] 中回收EV。
另一个需要考虑的因素是样本量,对于脑脊液样本来说,样本量特别少,而许多EV分离技术需要相对较大的样本量。如果UC中使用的体积过小,试管会坍塌,样品会丢失。这就需要对小样品进行稀释,即使考虑到稀释因子,也会导致稀释样品内EV数显著减少。这意味着一些EV可能会在稀释过程中“消失”;这是如何发生的尚不清楚,但可能包括EV与稀释过程中使用的额外塑料(例如移液管和试管)的结合。在脑脊液中,EV的浓度已经低于其他生物液,在处理过程中尽量减少EV损失尤为重要。因此,避免预分离稀释的技术是理想的,比如那些适合小体积的技术。值得注意的是,qEV列的尺寸范围适用于所有的样品体积,从150 μL的qEVsingle到最大的100mL的qEV100(表2)。

表2. 不同qEV的上样量。
另一种分离EV的方法是使用指向EV表面蛋白的抗体进行免疫捕获。免疫捕获的纯度通常高,但产量通常很低。然而,EV本质上是异质的,具有不同的表面蛋白质,并以不同的水平携带它们。因此,使用免疫捕获只能分离出EV的特定群落。即使你的目标是来自特定细胞的EV,也不能保证来自该细胞的所有EV都会携带特定的标记,这意味着其他EV可能会被遗留下来,因此会未被包括在之后的分析中。许多抗体针对的神经元蛋白是L1CAM。最近的证据对这种方法提出了质疑,在该领域引发了激烈的争论 (研究分享 | L1CAM的争议:是否是脑源性细胞外囊泡的标记物?)。支持和反对L1CAM作为免疫捕获的神经元EV标记的有用性的证据已经被广泛覆盖,并且争论仍在继续。总的来说,虽然免疫捕获具有一定的特异性,但它既不是最有效也不是最可靠的技术。SEC仍然是从脑脊液中分离纯化EV的较优选择 [5]。
脑脊液EV可能的医学重要性
中枢神经系统疾病非常复杂。它们的诊断和监测具有根本性的困难,需要进一步的研究来阐明其发病机制。这使得对CSF EV的研究成为这些研究领域潜在的富有成效的努力。然而,迄今为止,脑脊液中EV的研究质量落后于其他生物液体。许多脑脊液研究没有分离他们的“EV”,而是直接从脑脊液分析。另一些则采用未经验证的DIY技术(例如,在不去除可溶性蛋白质的情况下,使用0.1 μm孔径过滤 [7])。许多这些研究中,也没有遵守MISEV指南,这可能解释了CSF EV研究缺乏一致的结果。
CSF EV的主要研究和亮点
疾病 | 研究亮点 |
阿尔茨海默病 (AD) |
|
帕金森氏症 (PD) |
|
肌萎缩性脊髓侧索硬化症 (ALS) |
|
多发性硬化 (MS) |
|
胶质瘤 |
|
CSF EV研究未来的关键问题
由于中枢神经系统神经退行性疾病和癌症病理的严重程度,CSF EV是潜在的生物标志物,因此对CSF EV进行良好研究具有重要的医学意义。该领域仍存在几个关键问题和关注领域,必须解决这些问题以提高研究质量,并增加识别可行生物标志物和病理机制的可能性。
1. CSF EV领域是否同意改进EV分离纯化和表征方法? 与其他生物流体中使用的方法相比,目前该领域内EV分离方法的质量相对较差。它们也是高度异质性的,这意味着不同研究中分离纯化的是EV的不同亚群和污染物,导致研究之间缺乏一致性。EV的特征描述同样不够完善,许多论文——甚至是最近发表的论文——都没有包括任何或很少的EV特征描述。该领域的研究可以受益于遵循MISEV的EV分离和表征标准。
2. 脑脊液EV生物标志物是否优于血浆生物标志物?与血浆样品相比,脑脊液样品具有较强的侵入性和较少的样本量,基于脑脊液EV的生物标志物具有独特的缺点。必须避免对患者进行潜在的无根据的侵入性手术。因此,与血浆EV的比较是任何潜在的CSF衍生EV生物标志物的重要一步。
3. 脑脊液中储存的EV的稳定性如何? 用于生物标志物研究的脑脊液在分离EV之前的储存条件和保存时间有很大差异。需要对脑脊液中储存EV的影响进行全面研究,以确定这种做法对使用这些样本的研究结果的影响。
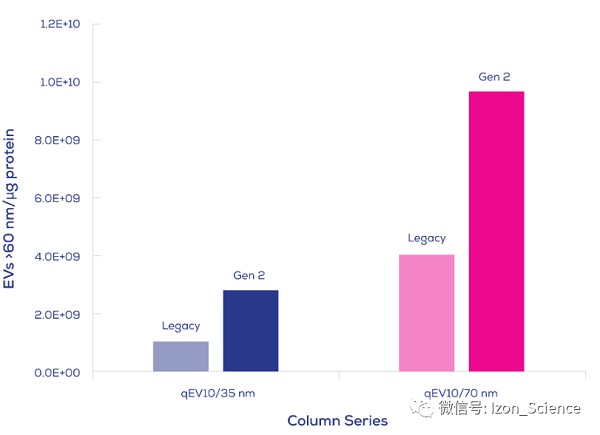
Izon Science的Gen 2 qEV外泌体用尺寸排阻纯化柱,生产符合ISO13485认证,带给您纯净的外泌体,纯度可高达约1.0E+10个颗粒每ug蛋白 (1.0E+13个颗粒每mg蛋白,10mL人血浆上样量),如下图Gen 2 qEV10参数








 药物筛选/分子生物学
药物筛选/分子生物学