加拿大科研人员利用Apogee Flow纳米流式对乳腺癌来源的细胞外囊泡的质量控制和检验的研究

细胞外囊泡(EVs)已被证明在促进肿瘤发生中起关键作用。随着EV研究的深入,在研究过程中建立标准化的分离、质量控制、表征和验证方法作为可靠的参考标准来作为问题排除解决方案是非常重要的。因此,本研究报告的目的是从多种乳腺癌细胞系中分离出EV,并按照国际细胞外囊泡学会 (International Society for Extracellular Vesicles) 的EV研究最小信息列表(MISEV)描述和执行实验方案。
加拿大科研人员对乳腺癌来源的细胞外囊泡的质量控制和检验的研究。本研究采用了两种EV分离方法:超离心法(UC )和尺寸排阻层析法(SEC)。为了符合MISEV的要求,进行了蛋白定量、阳性(CD9、CD63、TSG101)和阴性(TGFβ1、β-微管蛋白)标记物的免疫印迹、纳米流式细胞术(Apogee A60 Micro PLUS)分析和电镜观察。通过这些实验证明了EV的产量在不同的乳腺癌细胞系之间存在差异。本课题对EV研究方案进行了优化,以适应低产量EV的表征,并包括各种技术和问题排除建议,以更好地应用于其他类型细胞来源的EV,必将对未来的研究人员带来益处。
使用DC蛋白检测试剂盒定量EV样品的总蛋白浓度。对于低产量的EV样品,使用Micro BCA蛋白测定试剂盒定量,样品稀释10倍,对EV蛋白样品进行一致体积(35µL)的免疫印迹实验。
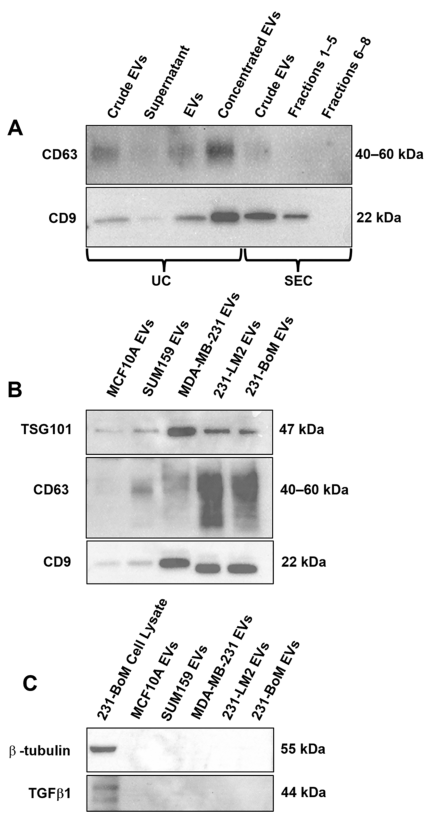
Fig.1
(A)通过超离心(UC)和尺寸排阻层析(SEC)分离后EV CD9和CD63的蛋白水平。SUM159细胞在缺氧条件下培养,使用UC或SEC从细胞培养基中分离EV。EV蛋白样品使用一致体积(35µL)进行免疫印迹验证。1– 4孔为UC分离的EV,孔1:使用 UC前的EV(培养基);孔2为UC后上清裂解液;孔3为UC后的EV;孔4 为使用Ultra-4离心过滤器(100 kDa)进行额外浓缩后的EV。孔5-7为SEC分离的EV,孔5为分离前的EV(培养基),孔6为来自SEC后1-5 EV(混合物);孔7为来自SEC 6-8的EV(混合物)。(B, C)特异性蛋白质表征EV,采用超速离心方法从缺氧培养的不同乳腺细胞系中分离EV,包括MCF10A(非恶性乳腺上皮细胞)、SUM159、MDA-MB-231(三阴性)、231-BoM(骨转移三阴性)和231-LM2(肺转移三阴性)。
使用Apogee flow系统(A60 Micro PLUS)用于评估EV样品中的颗粒大小分布和颗粒的相对丰度(图2)。对于在缺氧条件下获得的所有乳腺源性EV样品,大多数EV的大小都在180 nm范围内,尽管在特定细胞系中也检测到更大粒径的EV。与免疫印迹结果相似,本研究还观察到细胞系之间EV产量(颗粒/µL)的差异,MCF10A和SUM159细胞的EV产量最低(图2A, B), 231-BoM细胞的EV产量最高(图2E)。这种EV大小和产量的变化性说明了来自不同患者的乳腺癌细胞之间的内在异质性,并强调了使用多细胞系模型进行癌症EV研究的重要性。
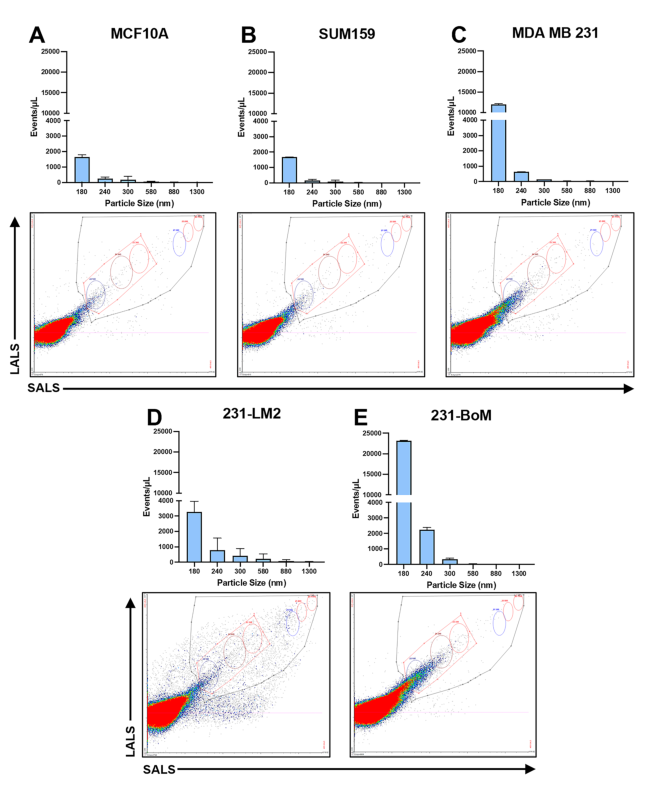
Fig.2
乳腺源性EV的粒径分布特征。采用超速离心技术从MCF10A、SUM159、MDA-MB-231、231-BoM和231-LM2等低氧培养的乳腺细胞系中分离出EV。每个EV样品用PBS中稀释10倍,体积为300µL使用Apogee A60 Micro PLUS纳米流式细胞仪进行分析。(A-D) MCF10A、(B) SUM159、(C) MDA-MB-231、(D) 231-LM2和(E) 231- BoM乳腺细胞系EV样品的颗粒数(y轴)和粒径(x轴)分布。颗粒数/µL表示为平均值±标准差(n= 2),并归一化为收获时的细胞数。流式图显示了小角度光散射(SALS)和大角度光散射(LALS),并在图中做了量化处理。不同粒径的标准珠(180nm, 240nm, 300nm, 580nm, 880 nm和1300nm)在细胞图上用圆圈表示。
本研究进行了TEM阴性染色,与之前的文献结果一致,观察到在缺氧条件下分离的乳腺源性EVs可视为圆形结构(图3)。然而,根据制备和试剂的不同,EVs也可以呈现杯状。在高分辨率透射电镜下,如细胞碎片,会产生背景污染,干扰电子显微镜成像。通过使用的PBS洗涤,确保颗粒完全重悬浮,并冲洗样品以去除缓冲盐粒子,可以提高图像质量。可以在不稀释的情况去除污染物,这对于低产量样品(即来自MCF10A, SUM159细胞) 成像至关重要。
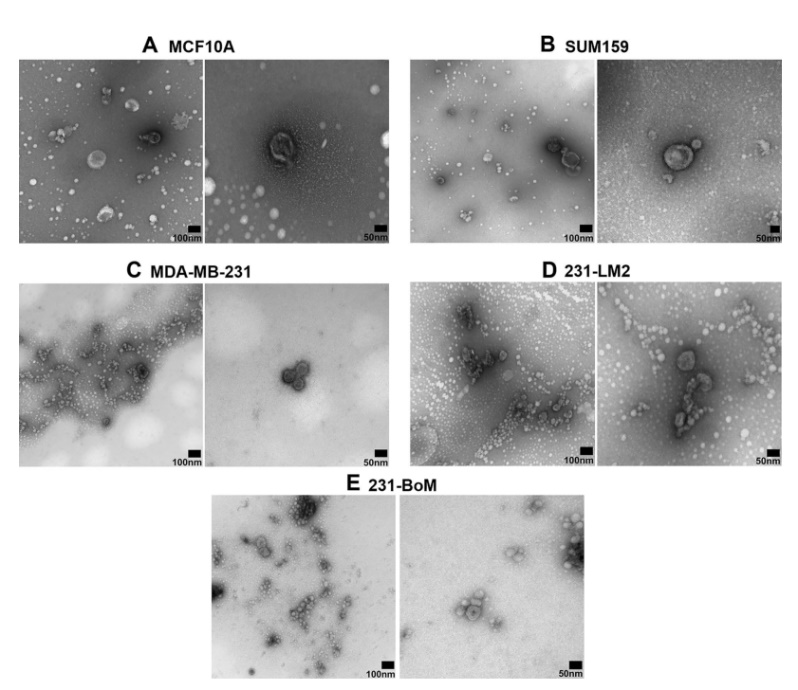
Fig.3
图3透射电子显微镜(TEM)表征EV的形态。采用超离心技术从MCF10A、SUM159、MDA-MB-231、231-BoM和231-LM2等不同的乳腺细胞系中分离出EV。样品以3µL体积在PBS中制备,使用JEOL JEM 1200 EX TEMSCAN显微镜进行透射电镜观察。(A) MCF10A, (B) SUM159, (C) MDA-MB-231, (D) 231-LM2, (E) 231- BoM。
结论
在进行EV研究时,重要的是要考虑以下因素:所使用的术语和定义、EV的来源、以及用于分离、浓缩、表征和储存的技术。记录这些参数将有助于符合MISEV指南要求,并确保研究的方法可以复制。本研究报告中描述的验证方案对有兴趣研究EV的研究者有价值,可以提供克服EV研究过程中遇到的常见问题的参考,并帮助符合MISEV要求,确保整个EV研究领域的标准化。
英国Apogee超灵敏纳米流式分析仪,专为外泌体微囊泡(EVs)等小颗粒分析优化设计,在EVs样品颗粒大小分析,绝对定量,多标记物同时快速分析工作中广泛应用。截止目前,该设备已累计参与数百篇高质量同行审议文章相关实验分析工作。其出色的灵敏度,稳定性及可靠性已备受业内广泛认可,并将继续为EVs相关基础研究及转化应用提供坚实支持。
Apogee纳米流式除了可用于纳米级别的颗粒 (如:细胞外囊泡、外泌体、微生物、病毒颗粒、LNP) 等,还可以用于作常规动物细胞检测 (如免疫细胞、哺乳类动物细胞、等)。它是一台全面且功能强大的纳米流式分析仪!

参考文献:
Quality control and validation ofextracellularvesicles isolated from cultured human breastcancer cells. Urvi Patel', David Susman' and Alison L. Allan1.23.4”,(2024) 17:202Pateletal. BMCResearch Notes, https://doi.org/10.1186/s13104-024-06865-x
欢迎关注进科驰安官方微信(微信公众号:Bio-Gene)
回复:apogee,查看更多相关视频
长按/扫描以下二维码可识别关注公众号

广州进科驰安科技有限公司
Bio-Gene Technology Ltd.
热线:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 广州 济南








 Drug Screening/Molecular Biology
Drug Screening/Molecular Biology