MP应用|定量表征蛋白质-DNA间的相互作用
蛋白质-DNA相互作用在DNA修复、复制和转录等活细胞调节过程中发挥着关键作用1。然而,使用传统的生物分析工具研究这些相互作用时通常是比较困难的,这是因为该相互作用中涉及了高度异质复合物的形成2。质量光度法则非常适合此类相互作用体系的研究,它可以快速测量溶液中不同生物分子(例如DNA和蛋白质)的质量,并且无需标记和固定2。通过表征生物分子的质量分布,该方法详细表征溶液中的各个蛋白质和DNA组分,他们形成的复合物,以及每种组分的相对丰度,并且也能够定量给出相互作用体系的亲和力。此外,使用Refeyn专有的新型多功能MassGlass CC 玻片,使质量光度法测定蛋白质-DNA相互作用变得更加容易(图1)。该玻片消除了测量不同样品需要手动修饰玻片的过程,MassGlass CC 玻片有助于在单次质量光度测量中测量实验中的高度异质复合物,节省了用户的时间,并且降低了不同批次实验带来的差异。 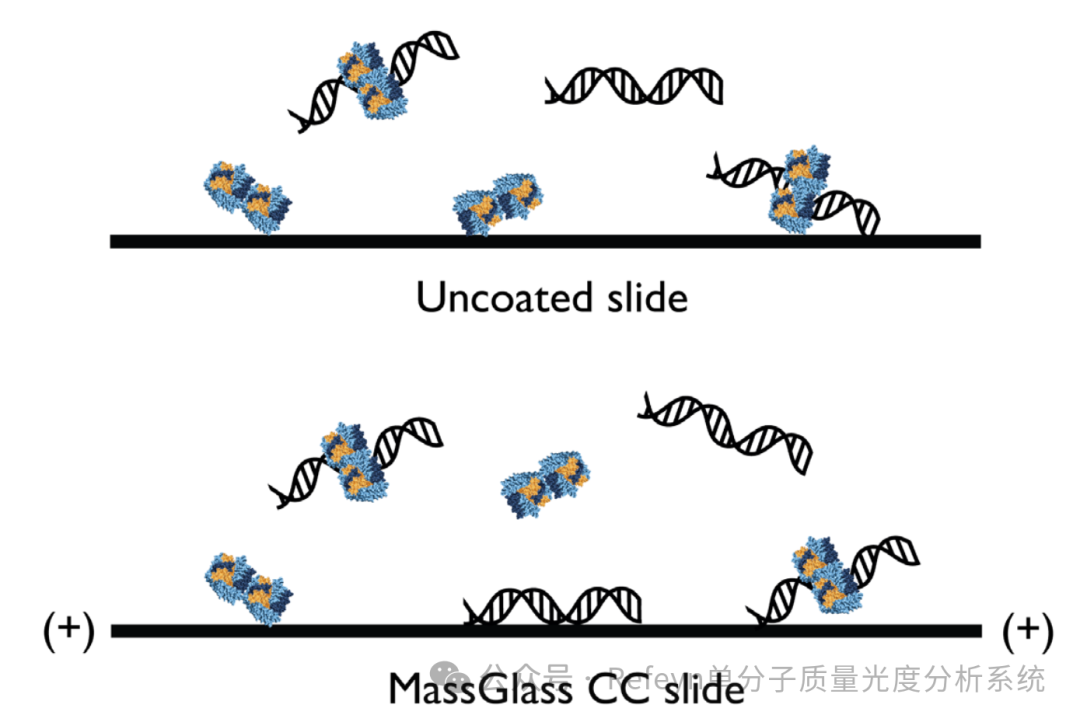 图1. 不同生物分子与MassGlass CC玻片相互作用示意图。质量光度法需要生物分子与玻片表面发生相互作用;然而,带有强烈负电荷的核酸分子往往被未修饰玻片排斥,这导致核酸分子与玻片的结合频率较低,并且往往是瞬时的,这导致质量光度测定数据中的结合事件比较少,并且定义不是很准确。Mass Glass CC玻片具有阳离子表面电荷,有利于蛋白质和核酸与玻片表面的相互作用,从而可以在单次测量时同时测量蛋白质和DNA分子以及他们形成的复合物。为了展示MassGlass CC如何简化用户的工作流程,我们使用这些玻片进行了一系列的质量光度测定实验,该研究涉及端粒重复结合因子2(TRF2)与双链端粒DNA之间的相互作用。TRF2抑制DNA损伤反应并起到保持端粒完整性的功能3,4,这时TRF2:DNA的表征尤为重要,帮助科学家们更深入了解这些生物学过程以及他们与衰老相关疾病中端粒功能障碍的关系。使用TwoMP质量光度计和Mass Glass CC玻片,我们定量测量了参与反应的每种组分及它们形成复合物的相对丰度,并计算了该相互作用中的平衡解离常数(KD)。蛋白质-DNA相互作用的表征质量光度法非常适合研究相互作用和复合物的形成。在所展示的案例研究中,TRF2以150nM和端粒DNA以1:1的比例混合,并在室温下孵育15分钟,使复合物的反应达到平衡。孵育后,通过在样品孔的原位稀释样品测量样品,样品的终浓度为15nM。结果清楚显示了TRF2二聚体(126kDa),DNA(53kDa)以及他们相互作用形成的复合物(194kDa)(图2)。
图1. 不同生物分子与MassGlass CC玻片相互作用示意图。质量光度法需要生物分子与玻片表面发生相互作用;然而,带有强烈负电荷的核酸分子往往被未修饰玻片排斥,这导致核酸分子与玻片的结合频率较低,并且往往是瞬时的,这导致质量光度测定数据中的结合事件比较少,并且定义不是很准确。Mass Glass CC玻片具有阳离子表面电荷,有利于蛋白质和核酸与玻片表面的相互作用,从而可以在单次测量时同时测量蛋白质和DNA分子以及他们形成的复合物。为了展示MassGlass CC如何简化用户的工作流程,我们使用这些玻片进行了一系列的质量光度测定实验,该研究涉及端粒重复结合因子2(TRF2)与双链端粒DNA之间的相互作用。TRF2抑制DNA损伤反应并起到保持端粒完整性的功能3,4,这时TRF2:DNA的表征尤为重要,帮助科学家们更深入了解这些生物学过程以及他们与衰老相关疾病中端粒功能障碍的关系。使用TwoMP质量光度计和Mass Glass CC玻片,我们定量测量了参与反应的每种组分及它们形成复合物的相对丰度,并计算了该相互作用中的平衡解离常数(KD)。蛋白质-DNA相互作用的表征质量光度法非常适合研究相互作用和复合物的形成。在所展示的案例研究中,TRF2以150nM和端粒DNA以1:1的比例混合,并在室温下孵育15分钟,使复合物的反应达到平衡。孵育后,通过在样品孔的原位稀释样品测量样品,样品的终浓度为15nM。结果清楚显示了TRF2二聚体(126kDa),DNA(53kDa)以及他们相互作用形成的复合物(194kDa)(图2)。
 图1. 不同生物分子与MassGlass CC玻片相互作用示意图。质量光度法需要生物分子与玻片表面发生相互作用;然而,带有强烈负电荷的核酸分子往往被未修饰玻片排斥,这导致核酸分子与玻片的结合频率较低,并且往往是瞬时的,这导致质量光度测定数据中的结合事件比较少,并且定义不是很准确。Mass Glass CC玻片具有阳离子表面电荷,有利于蛋白质和核酸与玻片表面的相互作用,从而可以在单次测量时同时测量蛋白质和DNA分子以及他们形成的复合物。为了展示MassGlass CC如何简化用户的工作流程,我们使用这些玻片进行了一系列的质量光度测定实验,该研究涉及端粒重复结合因子2(TRF2)与双链端粒DNA之间的相互作用。TRF2抑制DNA损伤反应并起到保持端粒完整性的功能3,4,这时TRF2:DNA的表征尤为重要,帮助科学家们更深入了解这些生物学过程以及他们与衰老相关疾病中端粒功能障碍的关系。使用TwoMP质量光度计和Mass Glass CC玻片,我们定量测量了参与反应的每种组分及它们形成复合物的相对丰度,并计算了该相互作用中的平衡解离常数(KD)。蛋白质-DNA相互作用的表征质量光度法非常适合研究相互作用和复合物的形成。在所展示的案例研究中,TRF2以150nM和端粒DNA以1:1的比例混合,并在室温下孵育15分钟,使复合物的反应达到平衡。孵育后,通过在样品孔的原位稀释样品测量样品,样品的终浓度为15nM。结果清楚显示了TRF2二聚体(126kDa),DNA(53kDa)以及他们相互作用形成的复合物(194kDa)(图2)。
图1. 不同生物分子与MassGlass CC玻片相互作用示意图。质量光度法需要生物分子与玻片表面发生相互作用;然而,带有强烈负电荷的核酸分子往往被未修饰玻片排斥,这导致核酸分子与玻片的结合频率较低,并且往往是瞬时的,这导致质量光度测定数据中的结合事件比较少,并且定义不是很准确。Mass Glass CC玻片具有阳离子表面电荷,有利于蛋白质和核酸与玻片表面的相互作用,从而可以在单次测量时同时测量蛋白质和DNA分子以及他们形成的复合物。为了展示MassGlass CC如何简化用户的工作流程,我们使用这些玻片进行了一系列的质量光度测定实验,该研究涉及端粒重复结合因子2(TRF2)与双链端粒DNA之间的相互作用。TRF2抑制DNA损伤反应并起到保持端粒完整性的功能3,4,这时TRF2:DNA的表征尤为重要,帮助科学家们更深入了解这些生物学过程以及他们与衰老相关疾病中端粒功能障碍的关系。使用TwoMP质量光度计和Mass Glass CC玻片,我们定量测量了参与反应的每种组分及它们形成复合物的相对丰度,并计算了该相互作用中的平衡解离常数(KD)。蛋白质-DNA相互作用的表征质量光度法非常适合研究相互作用和复合物的形成。在所展示的案例研究中,TRF2以150nM和端粒DNA以1:1的比例混合,并在室温下孵育15分钟,使复合物的反应达到平衡。孵育后,通过在样品孔的原位稀释样品测量样品,样品的终浓度为15nM。结果清楚显示了TRF2二聚体(126kDa),DNA(53kDa)以及他们相互作用形成的复合物(194kDa)(图2)。质量光度法定量蛋白质-DNA的相互作用亲和力
为了获得有关TRF2:DNA相互作用亲和力的信息,我们使用15nM的质量光度测量数据计算了KD(图2).基于参考文献5中提供的方法,假设该相互作用已达到平衡,我们根据三次质量光度测量的平均值计算了KD,得到的结果为16.5±5.1nM;而当前,相互作用亲和力评估的金标准SPR获得结果(KD=14.8nM)相比,两种方法的结果符合的非常好,具有较高的一致性。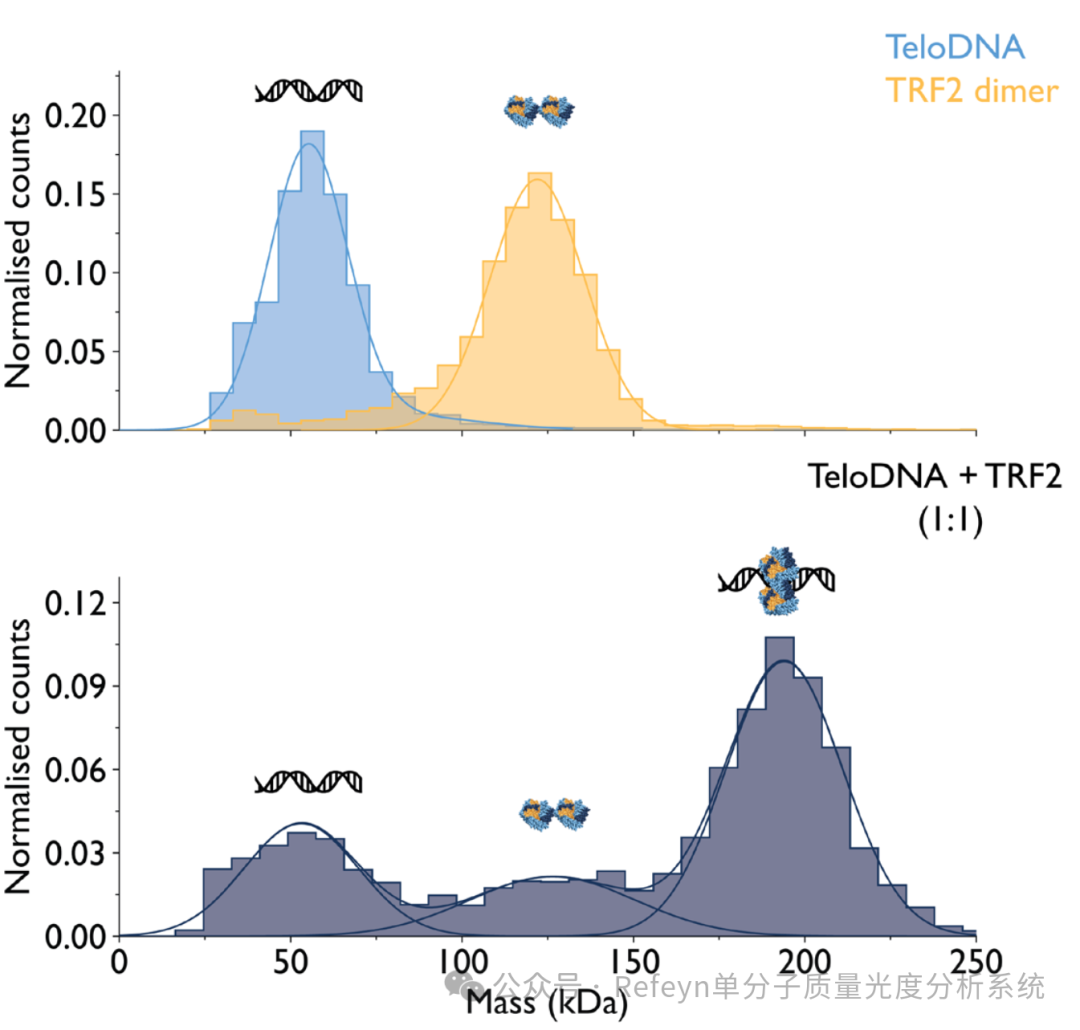
欢迎关注进科驰安官方微信(微信公众号:Bio-Gene)
回复:斑马鱼,查看更多相关视频
长按/扫描以下二维码可识别关注公众号

广州进科驰安科技有限公司
Bio-Gene Technology Ltd.
热线:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 广州 济南








 药物筛选/分子生物学
药物筛选/分子生物学