细胞外囊泡与子痫前期:从发病机制到诊断和治疗

简介: 子痫前期是早产的主要诱因。细胞外囊泡如何在发病机制、预测和治疗中发挥作用呢?
什么是子痫前期?它是如何引起的呢?
子痫前期是妊娠期的高血压和炎症性疾病,会增加血栓形成和随后器官衰竭的风险。子痫前期对胎儿也有危险,会增加生长限制和死产的风险。全世界约4.6%的妊娠中发生子痫前期 [1],其中每年有7万多例这种妊娠导致孕妇/人死亡,其中50万例导致婴儿死亡。如果不及时治疗,子痫前期会发展成子痫,这是一种比子痫前期更危险的疾病。尽管这一领域明显需要治疗方法,但目前除了症状管理外没有其他治疗方法。治疗子痫前期的唯一方法是分娩,或者更准确地说,是胎盘娩出。这通常意味着医源性早产,其中子痫前期的风险增加(adjusted odds ratio AOR, 校正OR 5.30) [2]。
子痫前期的发病机制尚未完全阐明,但被认为涉及几种潜在的同时发生和相互交织的致病途径。首先是子宫螺旋动脉重建不充分。这些紧密盘绕的动脉为胎盘提供血液,必须由绒毛外滋养细胞和免疫细胞重塑为宽阔的低压血管(图1)。这一过程的失败与胎盘损伤和缺氧有关。此外,胎盘已被证明可以释放抗血管生成因子,如可溶性血管内皮生长因子受体1 (sFlt-1),促进炎症的环境普遍存在。
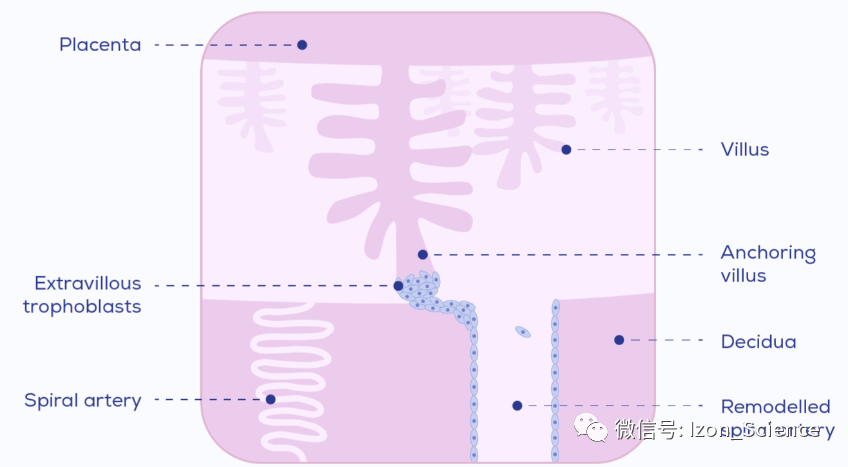
图1. 螺旋动脉重建示意图。绒毛外滋养细胞(EVTs)从胎盘绒毛的顶端向外迁移,侵入蜕膜螺旋动脉。在这里,它们与免疫细胞一起将动脉重塑为宽的,高导的,低压的血管。EVTs排列在重塑血管的管腔内,取代内皮。在子痫前期,这种重构是不完全的,没有到达肌层,留下高压,低导的血管,如图像左侧所示的螺旋动脉。
寻找生物标记物
子痫前期的生物标志物确实存在,并在临床实践中广泛应用。sFlt-1和胎盘生长因子(PlGF)之间的比值已被证明能很好地区分子痫前期和正常妊娠 [3,4]。然而,在实践中,sFlt-1:PlGF比值仅在妊娠晚期使用,并且已被证明在预测短期预后方面更有效 [5]。然而子痫前期在怀孕早期就已经有了根源,这意味着更早的预测是可能的。这就是研究人员转向细胞外囊泡(EVs)的原因,它是从胎盘和所有细胞中释放出来,可能允许外周采样,为了解早期子痫前期的发病机制提供一个窗口。
McElrath等人(2020年)的一项研究发现在妊娠早期中的较后时期的循环EV中有一组的蛋白质,在那些继续发展为子痫前期的孕妇和那些没有发展为子痫前期的孕妇中有差异 [6]。有趣的是,该研究分析在疾病确诊之前就发现了两组子痫前期患者。第一组的富集于与凝血和血小板脱颗粒有关的蛋白改变,第二组富集的是失调免疫反应(如补体蛋白)。第二组与更严重的子痫前期表型相关,分娩时胎龄明显提前,蛋白尿增多,并有恶化高血压的趋势 [6]。这给我们带来了希望,以EV为基础的生物标志物不仅可以预测早期妊娠的先兆子痫,而且也可以预测其严重程度,指导临床管理。
NX Prenatal公司正在推进这项研究,领导开发基于EV的生物标志物检测,以预测早期妊娠的子痫前期。NX Prenatal的首席执行官Brian Brohman回顾了NX Prenatal到目前为止的工作及其潜在影响:
“到目前为止,我们的研究表明,利用从母亲血浆中提取的EV衍生的多重蛋白组进行妊娠早期风险分层和分型是可行的。这种方法对子痫前期预防和治疗干预的未来优化和发展的潜在影响促使我们积极追求这些检测方法的商业化。我们现在还了解到,EV为我们提供了子宫-胎盘界面发生的重要分子通信信息,使我们能够在胎盘增生等症状中取得进一步突破。”
EV是否参与子痫前期的发病机制?
EVs已被证明在子痫前期的预测和分层中具有重要作用,这就引出了一个问题:EVs在发病机制中发挥什么作用?考虑到这些EV被发现含有炎症蛋白,这一点尤其令人感兴趣。
考虑到胎盘移除是子痫前期的有效治疗方法,因此胎盘可能扮演了一定的角色,促进疾病进展的因素可能从子痫前期的胎盘中释放出来。事实上,有证据表明子痫前期胎盘的合胞体滋养层细胞EV引起内皮损伤 [7,8],部分是通过一氧化氮合酶的调节。与来自健康胎盘的EV相比,子痫前期胎盘EV携带更少的一氧化氮合酶,并携带更多的miR-155,从而降低内皮细胞对一氧化氮(一种关键的血管扩张剂和抗氧化剂)的可利用性 [8,9]。
除了可能降低提供给内皮细胞的一氧化氮外,子痫前期胎盘的合胞滋养细胞EV也有促血栓作用,包括诱导血小板凝结 [10]。鉴于在子痫前期释放的合胞滋养细胞EV较多,特别是在早发型子痫前期 [13],胎盘源性EV的影响可能是子痫前期发病的重要因素。
EV疗法是子痫前期的潜在治疗方法吗?
如果EV有助于子痫前期的发病原因,是否可以利用其他EV进行治疗? EV用于治疗子痫前期是一种传递有益分子的方法;例如,长链非编码RNA H19。子痫前期胎盘有较高水平的miRNA let-7c,该miRNA let-7c下调FOXO1,可能抑制了绒毛外滋养细胞的迁移(参见图1了解其重要性) [14]。H19与let-7c结合,阻止其与FOXO1结合。含H19的间充质干细胞EV改善了绒毛外滋养细胞模型的迁移和侵袭,提示H19可能是一种有前途的治疗方法 [14]。一些处于原生状态的EV也有利于滋养细胞的迁移和增殖,如来自绒毛膜和脐带的间充质干细胞,以及来自子宫内膜细胞的间充质干细胞 [15-17]。人脐带间充质干细胞EVs也通过调节血管内皮生长因子信号,在体外增加内皮细胞管的形成,可能对抗子痫前期对内皮细胞的一些负面影响 [18-20]。这些研究为基于EV的子痫前期治疗提供了希望。
妊娠期临床相关EV:值得探索
随着对早产和子痫前期的EV生物标志物和治疗方法的研究持续增长,目前正在集中在相关检测的开发,例如NX Prenatal公司在生物标志物的发现和验证方面取得重大进展。开发过程充满了挑战,因为早产的诱因在很大程度上是未知的,可能是多因素造成的,其主要危险因素(例如子痫前期的原因)也是。这可能是因为两者都是可能通过一种以上的发病途径到达的疾病终结点。然而,这是一个拥有重大潜在利益的值得研究的领域。为了成功地发现生物标志物和治疗方法,需要对患者群体进行分层研究,以确保结果不被不同的发病途径所影响 [21]。因此,为此目的对患者进行充分分层研究的工具可能是推进该研究达到临床意义终点的关键。
Izon Science的Gen 2 qEV外泌体用尺寸排阻纯化柱,生产符合ISO13485认证,带给您纯净的外泌体,纯度可高达约1.0E+10个颗粒每ug蛋白 (1.0E+13个颗粒每mg蛋白,10mL人血浆上样量),如下图Gen 2 qEV10参数。
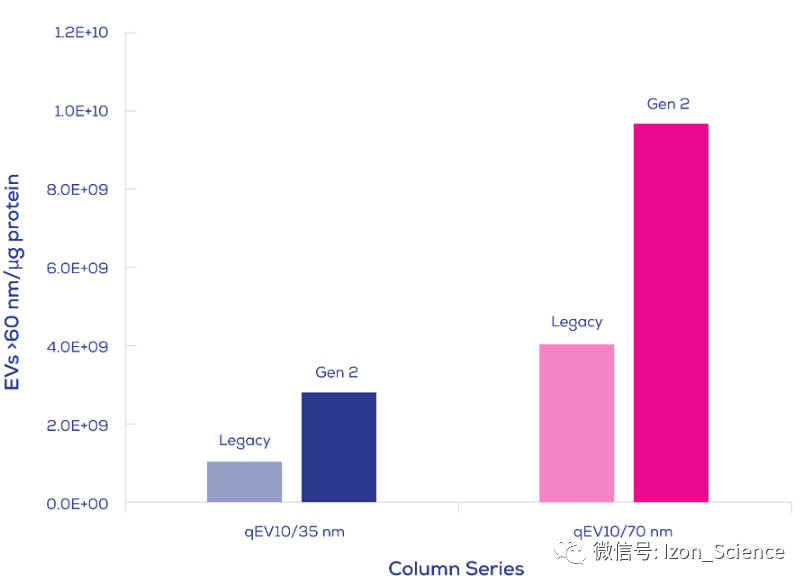
转载来源:Izon Science
欢迎关注伯齐官方微信(微信公众号:Bio-Gene)
回复:视频,查看相关视频
长按以下二维码可识别关注公众号

伯齐科技有限公司
Bio-Gene Technology Ltd.
广州伯齐生物科技有限公司
热线:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 广州 成都 济南








 药物筛选/分子生物学
药物筛选/分子生物学